目前,针对肺癌的EGFR-TKI靶向治疗已经成为非小细胞肺癌治疗的重要手段之一。尤其对于晚期肺癌患者,EGFR-TKI靶向治疗可显著延长其生存期并改善生活质量。2022年,第三代EGFR-TKI在EGFR-TKI药物市场中占据主导地位,占中国市场份额的73.0%。未来,第三代EGFR-TKI的市场份额将持续提升,预计至2033年将占中国EGFR-TKI市场的93.6%。
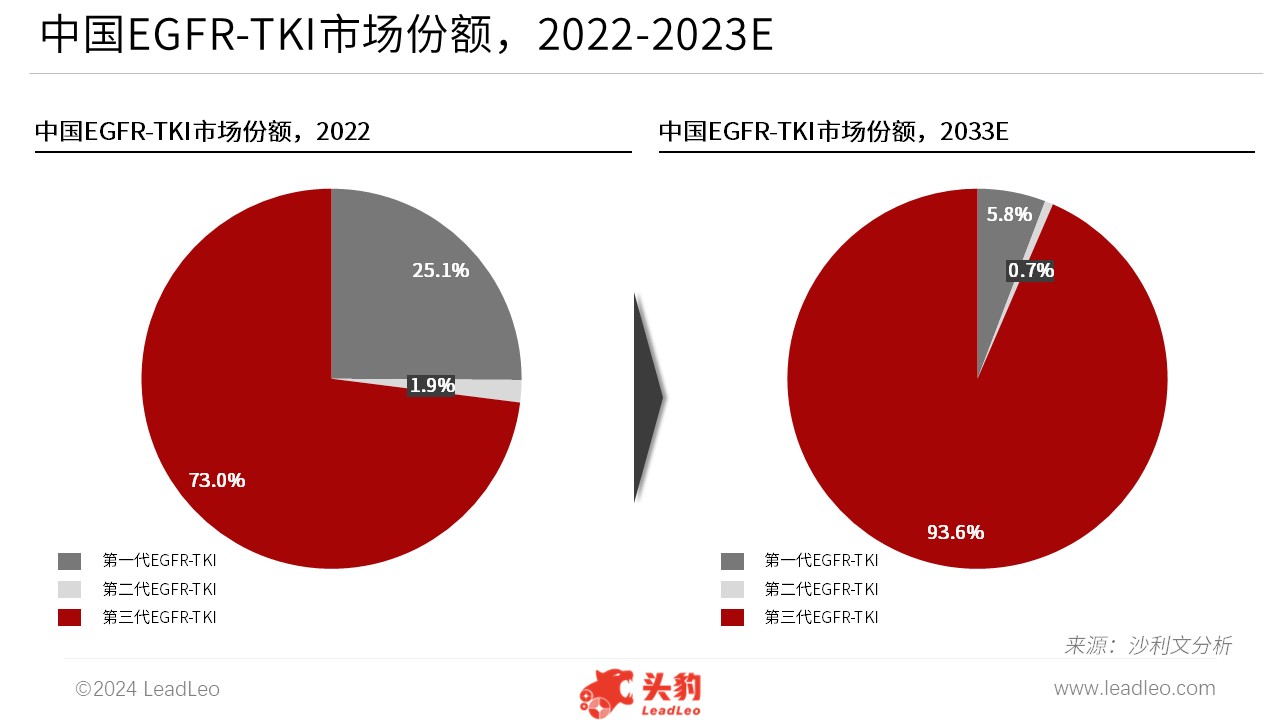
来源:沙利文分析
中国第三代EGFR-TKI的竞争格局
全球目前已批准上市的EGFR-TKI共有三代,中国是目前全球市场中拥有最多已上市的治疗非小细胞肺癌的三代EGFR-TKI市场,共有四款三代EGFR-TKI,分别为贝福替尼、伏美替尼、阿美替尼以及奥西替尼。
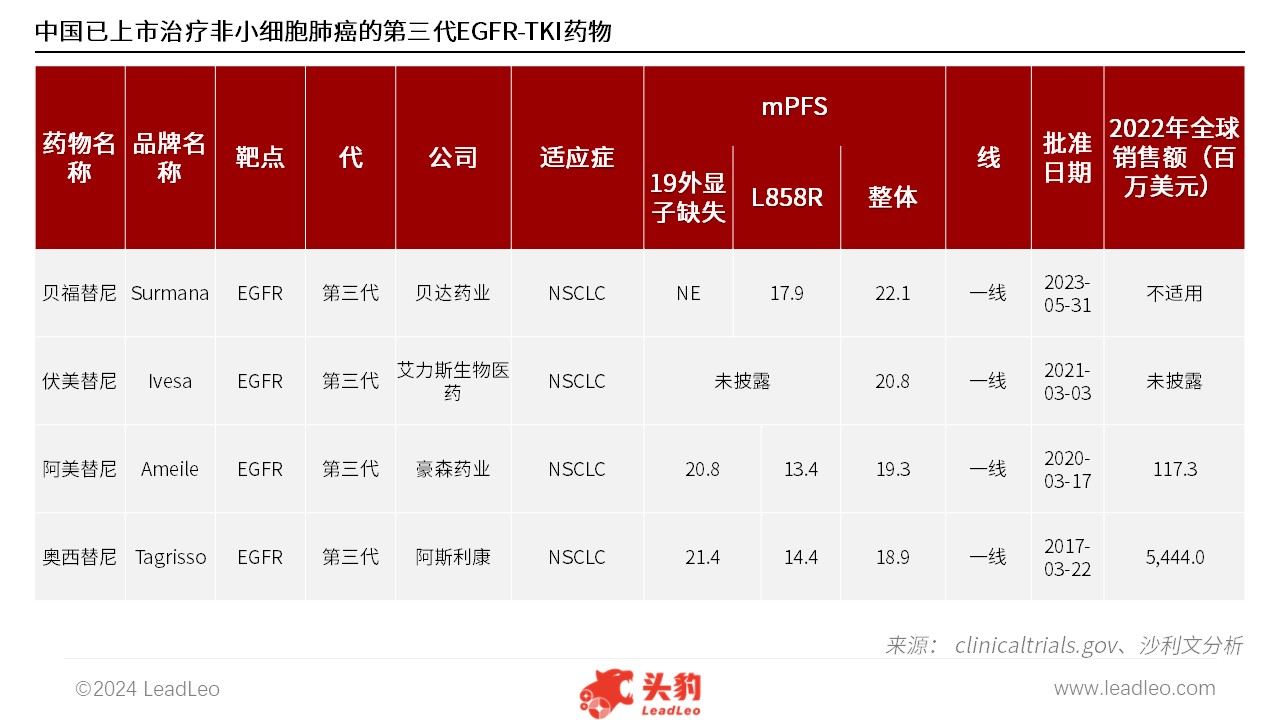
来源:国家药监局、沙利文分析
据同源康医药招股书披露,截至最后实际可行日期,中国共有12种非小细胞肺癌的第三代EGFR-TKI候选药物正处于临床开发阶段。其中,同源康医药的核心产品TY-9591在EGFR-TKI候选药物中占据领先地位。值得注意的是,TY-9591也是迄今为止唯一正在进行头对头关键实验的EGFR-TKI药物(以将其疗效与奥西替尼进行直接比较),亦是截止目前最有效的第三代EGFR-TKI药物。
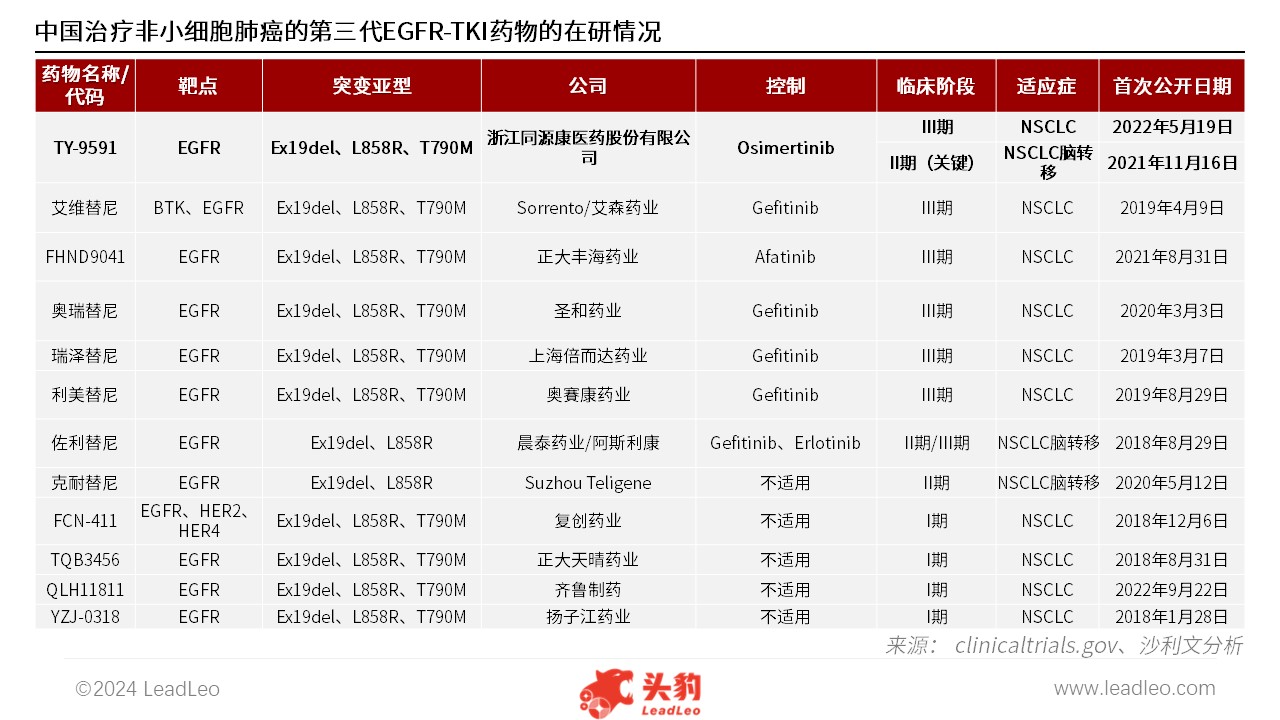
来源:国家药品监督管理局药品审评中心、沙利文分析
肿瘤新药领军企业,建立强大药物管线
浙江同源康医药股份有限公司(以下简称“同源康医药”)成立于2017年,是一家临床阶段的生物制药公司,作为一家立足中国、布局全球的肿瘤新药研发领军企业,公司致力于发现、开发差异化靶向疗法并对其进行商业化,以满足癌症治疗中亟待满足的医疗需求。公司的核心业务模式包括通过内部进行小分子药物和其他相关创新药物种类的发现、开发及商业化,以解决在癌症领域,特别是肺癌领域未满足的需求。
目前,公司已建立由11款候选药物组成的系列管线,靶点包括第三代EGFR、CDK4/6等。其中TY-9591是同源康医药潜在的同类最佳第三代EGFR-TKI药物,处于临床试验阶段。另外,公司还囊括关键产品TY-302、五款创新临床产品(以公司内部开发的关键产品TY-2136b为代表)以及处于临床前阶段的四款产品。
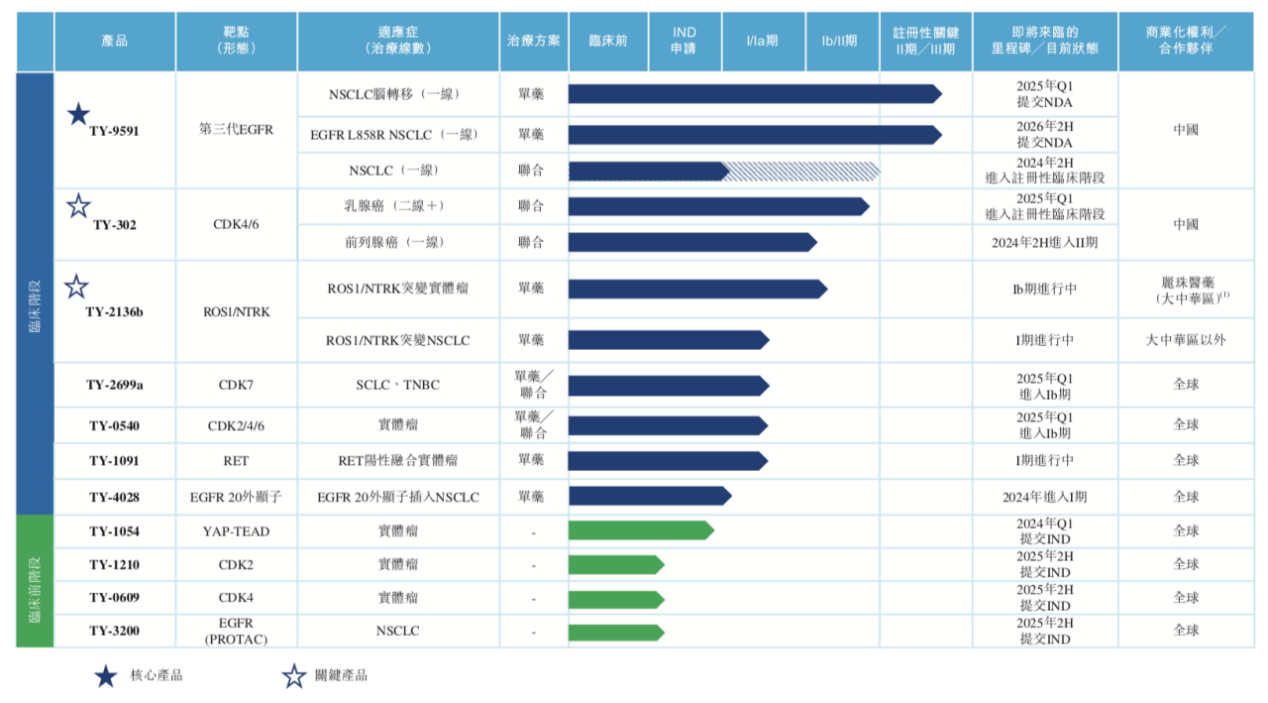
来源:同源康医药招股书
专注研发小分子抗肿瘤药物的平台,技术完善、实力强劲
同源康医药在研发方面投入了巨大的资金,2022年及截至2023年9月30日的九个月内,研发成本分别为2.3亿元和1.89亿元。公司的研发团队专注于小分子药物的研发,具备完善的技术平台,涵盖了从虚拟筛选、分子库到化学和生物方面的优化设计。此外,同源康医药还拥有先进的药物分析平台和质量控制体系,确保研发过程中的数据准确性和可靠性。
目前,同源康医药的主攻方向是络氨酸激酶抑制剂的研发,并逐渐将业务拓展至其他领域,公司丰富的研发管线将有助于推动公司的进一步发展,并为患者带来更多的优质药物。
核心产品TY-9591为潜在同类最佳第三代EGFR-TKI药物
公司核心产品TY-9591是一款潜在的同类最佳第三代EGFR-TKI药物,对EGFR突变具有抗肿瘤作用,并具有出色的血脑屏障渗透能力。公司目前正在研究TY-9591在EGFR突变非小细胞肺癌脑转移以及EGFR L858R突变的局部晚期或转移性非小细胞肺癌中的作用,主要因中国及全球市场暂未有针对非小细胞肺癌脑转移的药物获准上市,因此具有广大临床未满需求空间。
据招股书,TY-9591可以不可逆地与某些EGFR突变体结合,包括L858R突变、19外显子缺失、L858R/T790M突变和19外显子缺失/T790M突变,从而通过阻断酪氨酸激酶的磷酸化和细胞内信号通路(如Ras/Raf/MEK/ERK或PI3K/AKT通路)来抑制下游信号级联反应,最终抑制癌细胞的增殖和转移。此外,TY-9591在安全性方面的提升预计将可提供更长的治疗窗口。
据TY-9591的临床试验数据显示,在入组1b期及2期临床研究的29例从未接受治疗的可评估非小细胞肺癌脑转移患者中,25例患者达到颅内部分缓解(PR)及4例患者达到完全缓解(CR),颅内客观缓解率(ORR)为100%。在2期研究中,研究人员观察到严重不良事件的总体发生率为8.3%,治疗相关严重不良事件的发生率低至8.3%,显示出良好的安全性。根据这些令人鼓舞的临床数据,同源康医药正在就TY-9591单一疗法进行一项关键的2期临床试验,作为EGFR突变非小细胞肺癌脑转移的一线治疗。此外,1b期研究临床数据显示,TY-9591在78例可评估患者中表现出了良好的疗效和安全性,EGFR突变(L858R/19外显子缺失)NSCLC患者的中位无进展生存期(PFS)为21.5个月,其中19外显子缺失患者为25.7个月,L858R突变患者为19.3个月。研究人员确认的ORR为85.9%,其中19外显子缺失患者为85.7%,L858R突变患者为86.1%。此外,未观察到DLT,而不良事件的发生率和严重程度均可接受。研究人员正在进行TY-9591单一疗法作为一线治疗EGFR L858R突变的局部晚期或转移性NSCLC的注册性3期临床试验。